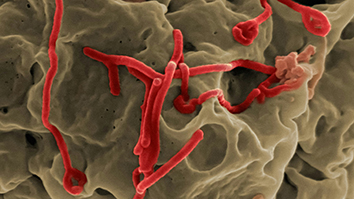
出血熱ウイルスがどのようにヒトの細胞を「乗っ取る」のかを特定するため、機械学習のアルゴリズムを活用
エボラ出血熱や黄熱病のような出血熱を引き起こすウイルスが、その宿主である人間や動物に及ぼす影響は壊滅的なものです。SRIの研究者たちは、バージニア工科大学やモントリオール大学のチームとの共同研究で、致命的であると考えられるウイルスを、AIを使って理解し、これらのウイルスに立ち向かう新しい方法を見つけようとしています。
この共同研究の研究者たちは、最近の論文において、サハラ砂漠以南のアフリカで主に見られる出血性のリフトバレー熱ウイルス(RVFV: Rift Valley Fever Virus)の宿主がもつ抗ウイルス免疫反応を解明しました。これは、RVFVと対峙する治療薬を開発するための第一歩であるのと同時に、同じような方法で免疫機能を攻撃する他の出血熱ウイルスに対しても治療薬開発の第一歩になるのではないかとみなされています。研究者たちが開発したAIツールは、出血熱ウイルスが細胞を「乗っ取る」様々な方法を解明するのに役立つことから、この先の医薬品開発につながるターゲットを示してくれる可能性があります。
「出血熱ウイルスの特徴を明らかにし、宿主をどのように操っているのかを明らかにするにあたり、生物学の研究とAIの統合を進めています」と、SRIのBiocomplexity Sciences(バイオコンプレクシティサイエンス: 生物複雑系科学)のプログラムディレクターであるPaul O’Mailleはこう述べています。「私たちの研究は、このようなウイルスの複製を阻止する新薬の開発につながる可能性があります」
RVFVは蚊が媒介するウイルスで人や家畜に感染する可能性がありますが、今のところ、このウイルスに対してFDA(米国食品医薬品局)が承認したワクチンや治療法はありません。人の場合、感染しても通常は軽症ですが、重症となる例では肝臓疾患や脳腫脹、出血熱となることがあります。家畜が感染すると、人の場合より致死率が高くなります。子牛や子羊、子ヤギはほぼ命を落としてしまいますし、成長した家畜でも感染すると約30%が死に至ります。加えて、妊娠している家畜はほぼ全例(ほぼ100%)流産してしまいます。
「Computational AIを使えば、膨大な数の配列を検討して、現実的な相互作用を見いだすことができます」―Paul O’Maille
バージニア工科大学のウイルス学教授でこのプロジェクトの主任研究員を務めるKylene Kehn-Hallは、「経済的にも、また公衆衛生の面からも、これは非常に大きな影響を及ぼすウイルスなのです」と述べています。
RVFVと宿主の細胞との相互作用がどのようなものであるのかを理解するために、研究者たちはタンパク質と結合して細胞プロセスをコーディネートする、短い配列のアミノ酸であるショートリニアモチーフ(SLiM: Short Linear Motif)に着目しています。ウイルスは宿主のSLiMを模倣して宿主が生来有しているプロセスを制御するよう進化し、感染した宿主の細胞がウイルスの感染を広げるべく働くようにします。SLiMであろうと思われるアミノ酸や、このような結合部位は数多く存在すると思われることから、あるウイルスのSLiMをひとつでも特定し、これが宿主と相互作用する場所を見つけ、その相互作用をブロックすることでウイルスの働きが止まるかどうかを判断するのですが、実験的手法だけでは何年もかかってしまいます。
AIはこの過程を劇的にスピードアップします。SRIの研究者たちは、既知のSLiM配列とその宿主との相互作用についてのデータベースで訓練した予測モデルを開発し、宿主細胞を干渉して制御する可能性のある出血熱ウイルスのSLiMを生成して特定しました。これらのSLiMは生化学者によってレビューされ、ウイルス学者に共有されました。ウイルス学者たちは細胞内での相互作用をテストし、理解するための実験を行います。
「私たちはComputational AIを使えば、膨大な数の配列を検討して生物物理学的シミュレーションを実施し、SLiMの現実的な相互作用を見いだすことができます。私たちの共同研究者は、細胞生物学の側面に集中してその結果を検証することで、出血熱のウイルスがどのように働くのかを解明できます」とO’Mailleは述べています。
この結果は機械学習のアルゴリズムにフィードバックされ、AIの予測を改善するのに役立ちます。多くのウイルスが体内で拡散する際に同じ原理を使っているため、SLiMが同じではない他の出血熱ウイルスについても、この結果を活用すれば理解しやすくなるのです。
「SRIは、Computational Biology(計算生物学)の分野における複雑かつ現実的な問題に取り組むにあたり、独自の学際的アプローチを導入しています」とO’Mailleは語っています。